2024年のノーベル化学賞は、機械学習を用いて生物学の最大の課題の1つに取り組んだDemis Hassabis、John Jumper、David Bakerに授与された。その課題とは、タンパク質の3D構造を予測し、一から設計することである。
今年の受賞は、テクノロジー企業で生まれた研究が評価されたという点で際立っている。DeepMindは、2014年にGoogleに買収されたAI研究のスタートアップである。これまでの化学賞の多くは、学術界の研究者に贈られてきた。多くの受賞者がその後、画期的な研究をさらに発展させ商業化するためにスタートアップ企業を設立した – 例えばCRISPR遺伝子編集技術や量子ドットなどがあるが – 研究自体は最初から最後まで商業分野で行われたわけではなかった。
物理学賞と化学賞は別々に授与されるが、2024年のこれらの分野での受賞研究には興味深いつながりがある。物理学賞は機械学習の基礎を築いた2人のコンピュータサイエンティストに贈られ、化学賞受賞者は機械学習を用いて生物学最大の謎の1つ、タンパク質の折りたたみに取り組んだことが評価された。
2024年のノーベル賞は、この種の人工知能の重要性と、今日の科学がいかに伝統的な境界を越えて異なる分野を融合し、画期的な結果を達成しているかを浮き彫りにしている。
タンパク質折りたたみの課題
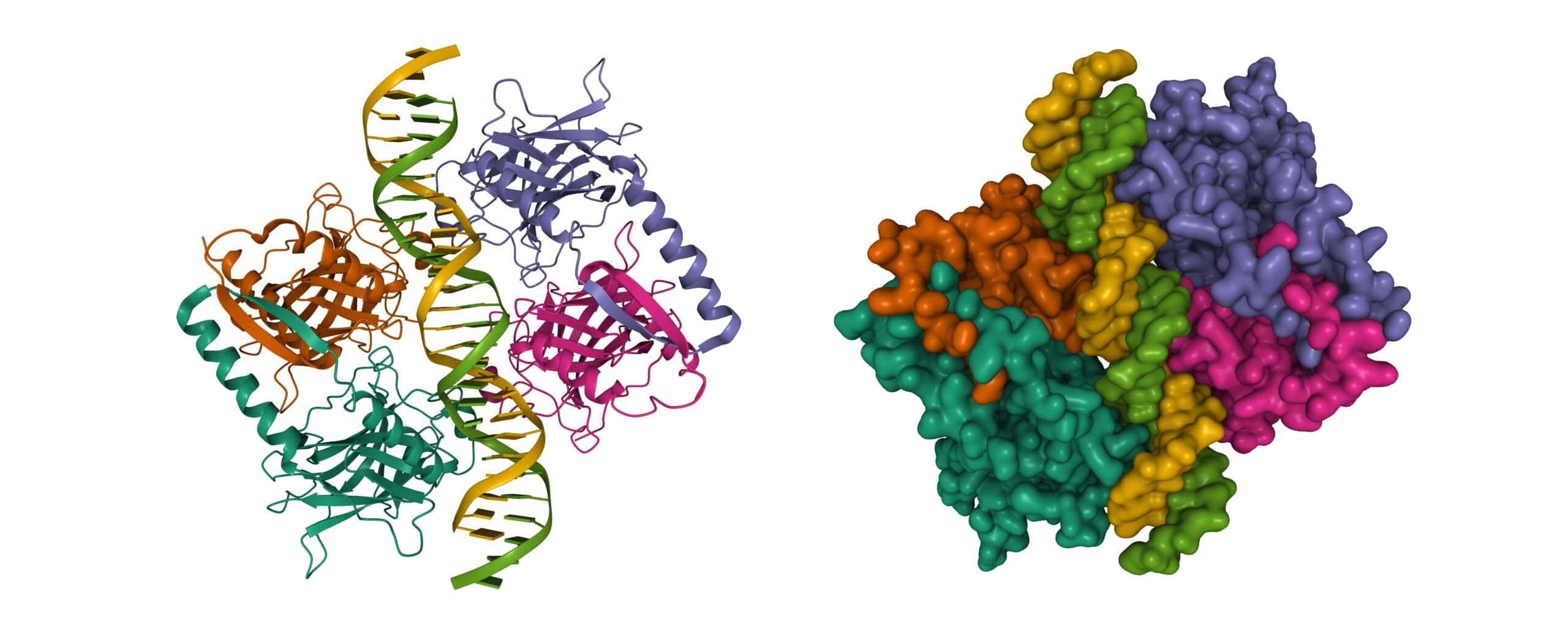
タンパク質は生命の分子機械である。タンパク質は、筋肉、酵素、ホルモン、血液、髪の毛、軟骨など、私たちの体の大部分を構成している。
タンパク質の構造を理解することは不可欠である。なぜなら、その形状がタンパク質の機能を決定するからだ。1972年、Christian Anfinsenは、タンパク質のアミノ酸構成要素の配列がタンパク質の形状を決定し、それがさらにその機能に影響を与えることを示したことでノーベル化学賞を受賞した。タンパク質が正しく折りたたまれないと、適切に機能しない可能性があり、アルツハイマー病、嚢胞性線維症、糖尿病などの疾患につながる可能性がある。
タンパク質の全体的な形状は、それを構成するアミノ酸のすべての原子間の微小な相互作用、引力と斥力に依存する。一緒にいたがるものもあれば、そうでないものもある。タンパク質は、これらの何千もの化学的相互作用に基づいて、ねじれ、折りたたまれ、最終的な形状になる。
数十年にわたり、生物学の最大の課題の1つは、アミノ酸配列のみに基づいてタンパク質の形状を予測することだった。現在、研究者はその形状を予測できるようになったが、タンパク質がどのように特定の形状に操作され、すべての原子間相互作用の斥力を数マイクロ秒で最小化するのかについては、まだ理解されていない。
タンパク質の働きを理解し、誤った折りたたみを防ぐために、科学者たちはタンパク質の折りたたみ方を予測する方法を必要としたが、このパズルを解くのは容易な作業ではなかった。
2003年、ワシントン大学の生化学者David Bakerは、タンパク質を設計するためのコンピュータプログラムRosettaを作成した。これにより、タンパク質の形状を設計し、それを作成するために必要なアミノ酸配列を予測することで、タンパク質折りたたみ問題を逆転させることが可能であることを示した。
これは驚異的な前進だったが、計算に選ばれた形状は単純で、計算は複雑だった。望ましい構造を持つ新規タンパク質を日常的に設計するには、大きなパラダイムシフトが必要だった。
機械学習の新時代
機械学習は、コンピュータが膨大な量のデータを分析することで問題解決を学習するAIの一種である。ゲームプレイや音声認識から自動運転車や科学研究まで、さまざまな分野で使用されている。機械学習の背後にある考え方は、データに隠れたパターンを使用して複雑な質問に答えることである。
このアプローチは、2010年にDemis Hassabisが神経科学とAIを組み合わせて現実世界の問題を解決することを目指すDeepMindを共同設立したことで大きな飛躍を遂げた。
4歳でチェスの神童だったHassabisは、超人的なレベルでチェスをプレイすることを自ら学習するAI、AlphaZeroですぐに話題となった。2017年、AlphaZeroは世界最高のコンピュータチェスプログラムStockfish-8を完全に打ち負かした。このAIがプログラムされた戦略に頼るのではなく、自身のゲームプレイから学習する能力は、AI界の転換点となった。
その後すぐに、DeepMindは同様の技術を、その複雑さで知られる古代のボードゲーム、囲碁に適用した。2016年、AIプログラムのAlphaGoが世界トップクラスのプレイヤーの一人、Lee Sedolを広く注目された対局で破り、何百万人もの人々を驚かせた。
2016年、Hassabisは新たな挑戦にDeepMindの焦点を移した:タンパク質折りたたみ問題である。タンパク質科学のバックグラウンドを持つ化学者John Jumperのリーダーシップの下、AlphaFoldプロジェクトが始まった。チームは実験的に決定されたタンパク質構造の大規模なデータベースを使用してAIを訓練し、タンパク質折りたたみの原理を学習させた。その結果、アミノ酸配列からタンパク質の3D構造を驚くべき精度で予測できるAI、AlphaFold2が誕生した。
これは重要な科学的ブレークスルーだった。AlphaFoldはそれ以来、2億を超えるタンパク質の構造を予測している – 本質的に、科学者が現在までに配列決定したすべてのタンパク質である。このタンパク質構造の大規模なデータベースは現在自由に利用可能で、生物学、医学、創薬の研究を加速させている。
疾患と戦うデザイナータンパク質
タンパク質がどのように折りたたまれ、機能するかを理解することは、新薬の設計に不可欠である。タンパク質の一種である酵素は、生化学反応の触媒として作用し、これらのプロセスを加速または調整することができる。がんや糖尿病などの疾患を治療するために、研究者はしばしば疾患経路に関与する特定の酵素を標的とする。タンパク質の形状を予測することで、科学者は小分子 – 潜在的な薬剤候補 – がそれにどこで結合する可能性があるかを理解できる。これは新しい薬を設計する最初のステップである。
2024年、DeepMindはAlphaFold3を発表した。これはAlphaFoldプログラムのアップグレード版で、タンパク質の形状を予測するだけでなく、小分子の潜在的な結合部位も特定する。この進歩により、研究者が適切なタンパク質を正確に標的とする薬を設計することがより容易になった。
GoogleはDeepMindを2014年に報道によると約5億ドルで買収した。Google DeepMindは現在、これらのAlphaFold3予測を使用して実際の創薬に製薬会社と協力するための新しいベンチャー、Isomorphic Labsを立ち上げた。
一方、David Bakerはタンパク質科学に重要な貢献を続けている。ワシントン大学の彼のチームは、「family-wide hallucination」と呼ばれるAIベースの方法を開発し、これを使用して全く新しいタンパク質を一から設計した。ハルシネーションとは新しいパターン – この場合はタンパク質 – で、AIの訓練データのパターンとよく適合する、つまり妥当なものである。これらの新しいタンパク質には発光酵素が含まれており、機械学習が新規の合成タンパク質の作成に役立つことが実証された。これらのAIツールは、自然に進化することはなかった機能的な酵素やその他のタンパク質を設計する新しい方法を提供する。
AIが研究の次の章を可能にする
Hassabis、Jumper、Bakerのノーベル賞に値する業績は、機械学習がコンピュータサイエンティストのためのツールだけでなく、今や生物学と医学の未来の不可欠な部分であることを示している。
生物学の最も困難な問題の1つに取り組むことで、2024年の受賞者たちは、創薬、個別化医療、さらには生命の化学に対する理解そのものにおいて新たな可能性を切り開いた。









コメント