生と死は伝統的に対極にあるものとして捉えられてきた。しかし、死んだ生物の細胞から新たな多細胞生命体が出現することで、生と死の伝統的な境界を超えた「第3の状態」が生まれている。
通常、科学者は死を、生物全体の機能が不可逆的に停止することと考えている。しかし、臓器提供のような現場では、生物が死んだ後でも臓器、組織、細胞が機能し続けられることを示している。この回復力は疑問を投げかける:生物が死んだ後も、特定の細胞が機能し続けられるのはどのようなメカニズムによるものなのか?
我々は生物が死んだ後に起こることを研究している研究者である。最近発表した総説で、特定の細胞が – 栄養、酸素、生体電気、または生化学的な刺激を与えられると – 死後に新しい機能を持つ多細胞生物に変化する能力があることを説明している。
生命、死、そして新たなものの出現
第3の状態は、科学者が通常細胞の振る舞いを理解する方法に挑戦している。芋虫が蝶に変態したり、オタマジャクシがカエルに進化したりする発達上の変化はよく知られているかもしれないが、生物が予め決められていない方法で変化する例はほとんどない。腫瘍、オルガノイド、HeLa細胞のようにペトリ皿で無限に分裂できる細胞株は、新しい機能を発達させないため、第3の状態の一部とは考えられていない。
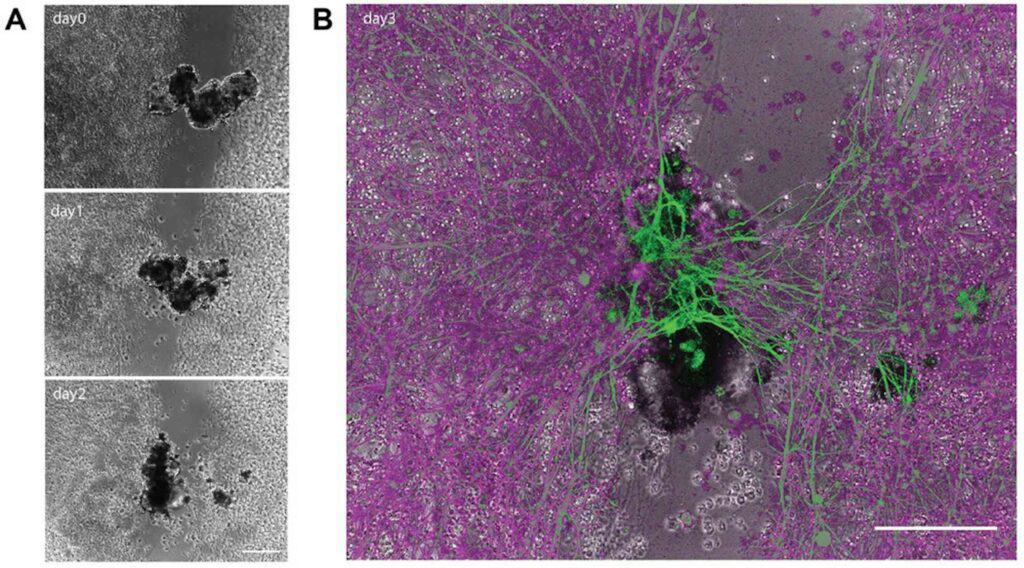
しかし、研究者たちは、死んだカエルの胚から抽出した皮膚細胞が、実験室のペトリ皿という新しい環境に適応し、自発的に多細胞生物であるXenobot(ゼノボット)に再編成できることを発見した。これらの生物は、元々の生物学的役割をはるかに超えた行動を示す。具体的には、これらのゼノボットは、繊毛 – 小さな毛のような構造 – を使って周囲を移動するが、生きているカエルの胚では、繊毛は通常粘液を動かすために使われる。
ゼノボットはまた、運動学的自己複製を行うことができる。これは、体内や体表面での成長を伴わずに、物理的に自らの構造と機能を複製できることを意味する。これは、生物の体内または体表で成長を伴う、より一般的な複製プロセスとは異なる。
研究者たちはまた、単独のヒトの肺細胞が自己組織化して、移動できる小さな多細胞生物になれることも発見した。これらのアンスロボット(Anthrobot)は、新しい方法で行動し、構造化されている。周囲を移動できるだけでなく、自己修復や、近くに置かれた損傷した神経細胞を修復することもできる。
これらの発見を総合すると、細胞システムに内在する可塑性を示し、細胞や生物が予め決められた方法でのみ進化できるという考えに挑戦している。第3の状態は、生物の死が生命の変容において重要な役割を果たす可能性があることを示唆している。
死後の条件
生物が死んだ後に特定の細胞や組織が生存し機能し続けられるかどうかには、いくつかの要因が影響する。これらには環境条件、代謝活性、保存技術が含まれる。
細胞の種類によって生存時間は異なる。例えば、ヒトの白血球は生物の死後60~86時間で死滅する。マウスでは、骨格筋細胞は死後14日後でも再生できる一方、ヒツジやヤギの線維芽細胞は死後1ヶ月程度まで培養できる。
代謝活性は、細胞が生存し機能し続けられるかどうかに重要な役割を果たす。機能を維持するために継続的で大量のエネルギー供給を必要とする活発な細胞は、エネルギー要求の低い細胞よりも培養が難しい。凍結保存などの保存技術により、骨髄などの組織サンプルを生きているドナー源と同様に機能させることができる。
固有の生存メカニズムも、細胞や組織が生き続けられるかどうかに重要な役割を果たす。例えば、研究者たちは、生物の死後にストレス関連遺伝子や免疫関連遺伝子の活性が著しく増加することを観察している。これはおそらく、ホメオスタシスの喪失を補償するためである。さらに、外傷、感染、死後経過時間などの要因が、組織や細胞の生存能力に大きな影響を与える。
年齢、健康状態、性別、種の違いなどの要因も、死後の状況をさらに形作る。これは、膵臓でインスリンを産生する代謝活性の高い膵島細胞をドナーから受容者に培養し移植する際の課題にも見られる。研究者たちは、自己免疫プロセス、高いエネルギーコスト、保護メカニズムの劣化が、多くの膵島移植の失敗の背景にあると考えている。
これらの変数の相互作用が、生物が死んだ後も特定の細胞が機能し続けられるようにする仕組みは、まだ不明確である。一つの仮説は、細胞の外膜に埋め込まれた特殊なチャネルとポンプが、精巧な電気回路として機能しているというものである。これらのチャネルとポンプは電気信号を生成し、細胞同士のコミュニケーションや、成長や移動などの特定の機能の実行を可能にし、形成する生物の構造を形作っている。
死後にどの程度さまざまな種類の細胞が変容できるかも不確かである。以前の研究では、マウス、ゼブラフィッシュ、ヒトにおいて、死後にストレス、免疫、エピジェネティック制御に関与する特定の遺伝子が活性化されることが分かっており、多様な細胞種間で広範囲な変容の可能性があることを示唆している。
生物学と医学への影響
第3の状態は、細胞の適応性に関する新しい洞察を提供するだけでなく、新しい治療法の可能性も提供する。
例えば、アンスロボットは個人の生きている組織から調達でき、望ましくない免疫反応を引き起こすことなく薬物を送達できる可能性がある。体内に注入された設計されたアンスロボットは、動脈硬化患者の動脈プラークを溶解したり、嚢胞性線維症患者の過剰な粘液を除去したりする可能性がある。
重要なのは、これらの多細胞生物には有限の寿命があり、4~6週間後に自然に分解することである。この「キルスイッチ」により、潜在的に侵襲的な細胞の成長を防ぐことができる。
生物の死後、ある程度の時間が経過してもなお一部の細胞が機能し続け、多細胞実体に変態する仕組みをより深く理解することは、個別化医療や予防医学の発展に期待をもたらす。









コメント